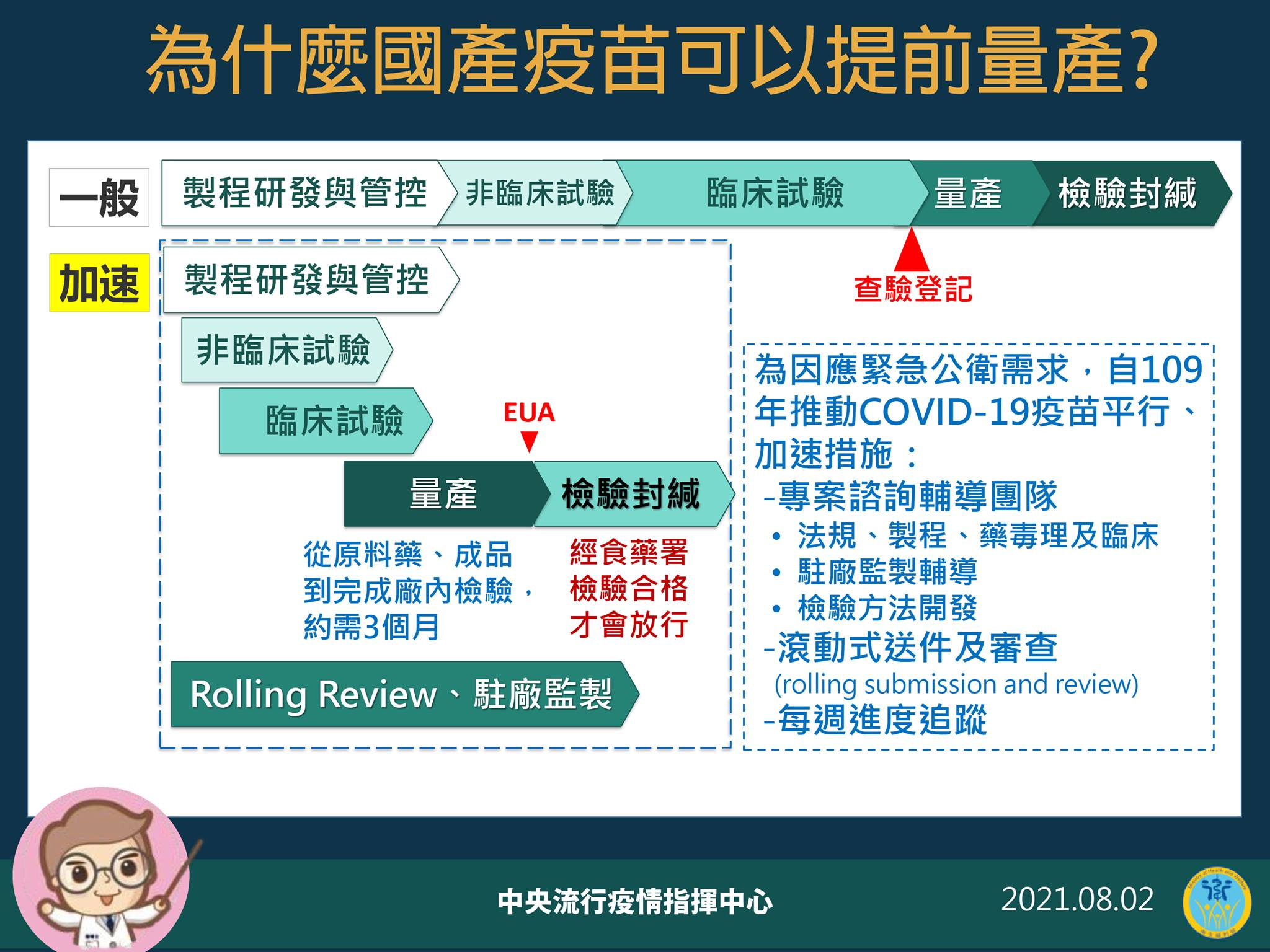
【健康醫療網/編輯部整理】衛福部食藥署2日宣布,四批高端疫苗已完成檢驗封緘作業,對於外傳高端疫苗率先於通過緊急使用授權(EUA)就已進行量產,並送審檢驗有所質疑,中央流行疫情指揮中心指揮官陳時中表示,如果等到通過EUA才進行量產,恐怕國產疫苗要等很久才能量產,且先量產也不一定會通過EUA,若未通過EUA先生產的疫苗就必須銷毀。
加速整體研發速度 同步研發及實驗
關於疫苗研發流程,陳時中表示,在研發跟檢驗平行進行,政府用獎金的方式做風險分擔,在行政上面在科學、法規的基礎下,讓行政程序縮短,臨床試驗才可以進行得快,包含原料購買、佐劑都先準備起來,如果等到通過EUA 再準備原料,需要半年以上,用欲採購的方式。
陳時中指出,研發時實驗同步進行,加速整體研發速度。一般流程依序為A到B到C,三者都要通過,在緊急授權的情況下,做到三分之二就開始進行下一部分,三階段都要通過才行,但需要投資更多錢,財務風險較高,並非每個廠商都願意這麼做,因為實驗沒有保證成功。
高端批號不連續 中間有問題須先補件
高端疫苗批號依序為SP2106、SP2107、SP2111及SP2112,此次放行4批號的產品共26.5萬劑,對於中間有3批號並不連續而遭外界質疑是否為品質不良遭食藥署退貨的批號。陳時中回應,蛋白質疫苗在檢驗上有很多要求,而中間的批號,每一個批號送進來都是延續的,中間有跳掉表示有一些問題要解決,問題分做檢驗不合格,以及技術性資料需要補件,若是檢驗不合格,那這批號要直接剔除、銷毀,但若是有技術的資料需要補件,則不會先封緘,待補件完成後才會驗。
把關EUA封緘品質 三者兼備才能放行
陳時中強調,無論先量產後還有品質監控、EUA、封緘檢驗等把關,三個條件下才能放到人體檢驗注射,要三者都通才可以放行。